|
CHIMIE DES EAUX

Pour bien comprendre le
fonctionnement d'un écosystème captif, il est absolument indispensable de connaître quelques
notions de chimie des eaux de l'aquarium. Quand vous serez bien familiarisé avec cette chimie
un peu particulière, alors je vous recommande la lecture du "Précis technique de
l'aquarium marin" de Claude Vast,
sûrement le meilleur livre écrit sur le sujet jusqu'a maintenant. Je pars tout
de
même du
principe que maintenant tout le monde connait le fameux 'cycle de l'azote' dans
l'aquarium.
LE
pH
Le pH, autrement dit le
potentiel hydrogène est un élément important en aquariologie marine et récifal.
Il est nécessaire de le tester de temps en temps. Son importance est connue en
aquariologie récifale mais de moins en moins
d'aquariophile teste leur eau afin de contrôler la valeur du pH. Pourtant, dans un
milieu confiné comme l'aquarium, il est nécessaire de maîtriser tout les
paramètres physico-chimiques de l'eau. La valeur du pH conditionne la santé des
poissons, des invertébrés, des coraux, et bien plus encore...
Le pH idéal en eau de mer est situé entre
8.2 et 8.4
l'eau de mer est donc une eau alcaline. Plus le pH est bas, plus l'eau est
acide.
Il y a toujours dans un bac qui fonctionne bien, une variation du pH dans la journée. (par exemple 7.8 le matin et 8.4 le soir) Ceci s'explique par le fait que les algues
(supérieurs et inférieurs) produisent du gaz carbonique, ce qui engendre une augmentation de l'acidité, donc une diminution du
pH. La baisse du pH intervient la nuit, lorsque les algues n'ont plus d'activité photosynthétique. Filtrer l'eau
du bac à travers du sable de corail peut stabiliser le pH,
(mais attention à l'accumulation de nitrates dans ce type de système, le débit
doit être élevé) comme le réacteur à calcaire (à condition qu'il soit bien réglé), ou l'adjonction d'eau de chaux (le pH en sortie est élevé mais l'adjonction régulière d'eau de chaux tend à maintenir un pH relativement stable, aux alentours de 8.4) L'adjonction d'eau de chaux fera aussi monter le taux de calcium, idéal pour les coraux durs,
les invertébrés, les bénitiers, et dans une moindre mesure, les coraux
mous. Il est à noter qu'en milieu naturel, il n'y a pas ou très peu de
variations de l'équilibre acido-basique, c'est ce qui rend nos aquariums
différents.
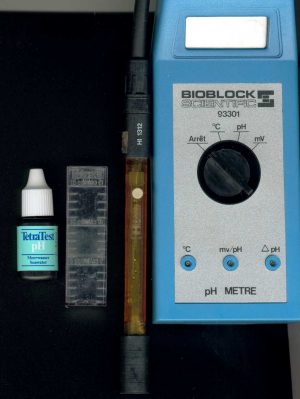 2 Solutions pour
tester votre pH. Le bon vieux test chimique (peu fiable mais économique) ou bien
le ph-mètre électronique .(encore un peu trop cher, comptez environ 90 euros)
. Ne parlons
pas des tests en bandelettes qui ne sont pas très fiables en aquariophilie
marine bien qu'elles peuvent vous donner une simple indication.
2 Solutions pour
tester votre pH. Le bon vieux test chimique (peu fiable mais économique) ou bien
le ph-mètre électronique .(encore un peu trop cher, comptez environ 90 euros)
. Ne parlons
pas des tests en bandelettes qui ne sont pas très fiables en aquariophilie
marine bien qu'elles peuvent vous donner une simple indication.
LE TH
Le TH (titre hydrotimétrique) ou le GH (valeur allemande) représente le taux des ions calcium et de magnésium. Cette valeur est exprimée en degré.
Cette unité est usuel en eau douce. Le th français correspond à 10 mg CaCO3 par litre. 1 th = 0.56 gh allemand.
LE TAC
Le tac (titre
alcalimétrique complet) représente la concentration en bicarbonate
(hydrogénocarbonate) et en carbonate. Cette valeur est aussi exprimée en degré. Le tac se nomme " la dureté carbonatée " : KH en allemand. Le KH en eau de mer doit être entre 7 et 12 degrés. 1 degré allemand = 1.78 degrés français.
Pour remonter le TAC en eau de mer, on utilise de
"l'eau de chaux".(ajouté de préférence en goutte à goutte sur une sortie de
pompe de brassage ou aux mieux dans la décant, surtout mettre uniquement l'eau
claire et non pas la solution blanchâtre(le lait de chaux !) qu'il reste au fond
de votre récipient)
LE GH ET LE KH SE MESURENT EN
DEGRÉ ALLEMAND CAR LA PLUPART DES TESTS COLORIMÉTRIQUE VENDUS DANS LE COMMERCE AQUARIOPHILE PROVIENNENT D' ALLEMAGNE !
LE rH
Le rH est appelé potentiel redox ou potentiel d'oxydoréduction. C'est la mesure de l'action oxydante de l'eau. Une oxydation trop puissante ou trop basse peut être la cause et la source de nombreux problèmes. (taux d'oxygène réduit, brûlures des branchies, asphyxies des poissons, productions de gaz néfastes, etc..)
Le potentiel redox est dépendant de la température et il est lié à la valeur pH
de l'eau. En contrôlant le rH sur une certaine période (permanente de
préférence) nous pouvons voir si les conditions physicochimique de l'aquarium
sont stables et aussi connaître le pouvoir de recyclage du bac. Un aquarium
marin en bonne santé doit avoir une valeur redox comprise entre 250 mV et 400
mV.
Les Nitrites

Les nitrites sont dangereux pour
tous les occupants de l 'aquarium. Le taux doit être contrôlé régulièrement
surtout lors de la phase de démarrage. Un taux important survient en général lors de la mise en
route du bac ou lorsque l'eau est surchargée en matières organiques et que les bactéries ne sont pas suffisantes pour les transformer en nitrates. Cela arrive aussi parfois lorsque vous rajoutez de nouvelles pierres vivantes, c'est la raison pour laquelle il est conseillé de mettre les pierres vivantes en une seule fois.
En cas de montée de nitrites, vous devez donc réensemencer votre bac artificiellement afin de faire baisser le taux de nitrites.(océanobacter, par exemple
ou biodigest)
Éventuellement un changement d'eau important pourra vous y aider.
Normalement, dans un bac parfaitement équilibré, vous ne devez pas avoir de nitrites. Je me répète, mais on ne les rencontre uniquement que dans la phase de démarrage
de l'aquarium lorsque le cycle de l'azote n'est pas encore établi. Si dans le cas ou vous devez rajouter des pierres vivantes dans votre bac, prenez garde qu'elles soient bien nettoyées (pas d'éponges en décomposition
par exemple ou d'autres sources de pollution...)
Les Nitrates
Contrairement aux nitrites, les nitrates sont moins dangereux pour les organismes marins. Mais attention, les invertébrés n'aiment en général pas du tout les nitrates, alors il est préférable de contrôler
régulièrement ce taux.
Un bac sain n'en contient qu'une quantité à peine mesurable.
Dans la plupart des cas, il vaut mieux avoir une teneur en nitrates inférieur à 10 mg/l. Les coraux sont plus sensibles aux nitrates et leur croissance peut stopper
voir régresser. Le mieux est d'introduire des algues supérieures comme des
caulerpes, qui sont de véritables pompes à nitrates, si vous ne pouvez pas les
introduire dans le bac principale, pensez à faire un refuge.
Il existe aussi une technique de filtration sur souffre qui diminue la teneur en nitrates.(technique mise au point entre autre par Mr Marc LANGOUET,
voir ici) Il faut 1 % du volume du bac en billes de souffre. Le
pH à la sortie étant relativement faible, il faut absolument faire passer l'eau sur un substrat calcaire afin de remonter le
pH à des valeurs un peu plus acceptable pour un bac récifal. Vous pouvez
retrouvez son article sur cette
page.
L' Ammoniac

L'
ammoniac est un élément extrêmement toxique pour nos pensionnaires, en général
on ne mesure pas le taux d'ammoniac sauf dans les cas extrêmes, un taux
d'ammoniac élevé peut provenir suite à la mort d'un poisson ou d'un invertébré
et à la décomposition de son cadavre dans le bac. Il est bon de savoir que l'ammoniac est
encore plus toxique si le pH est élevé.
L'eau de transport des poissons tropicaux est naturellement chargée en ammoniac,
la cause est, entre autre, les fèces du poissons durant le voyage. L'ammoniac
est un gaz mortel pour l'humain à très haute dose, mais rassurez vous, le cycle
de l'azote est là justement pour éliminer l'ammoniac et le transformer en
nitrites puis en nitrates.
Les
Phosphates
- Les phosphates se concentrent dans l'aquarium par la nourriture distribuée au poissons et par l'eau de rajout si celle-ci n'est pas osmosée. Un taux de phosphates important peut être une source d'envahissement par les algues
inférieurs. De plus, les phosphates peuvent bloquer la croissance des coraux car ils absorbent le calcium indispensable à la formation du squelette corallien.
- Si vous avez ce type de problème
avec vos coraux, pensez donc à contrôler votre taux de phosphates. Un nourrissage parcimonieux, l' introduction de détritivores
divers, d'escargots et le rajout d'un matériau filtrant spécial anti-phosphates peuvent vous aider à rétablir un équilibre dans le bac. ( l'oxyde d'aluminium, marche parait-il très bien, pourtant, il est semble t-il, inefficace à partir d'un PH de 7.5 ! )
Un taux de phosphates élevé peut conduire à l'eutrophisation
de votre bac et une arrivée d'algues inférieurs et de
diatomées. C'est en général là, que les ennuis
commencent...Il est peut être temps d'effectuer un bon
changement d'eau si vous ne pratiquez pas cette technique
régulièrement.
- L'ajout d'eau de chaux peut contribuer à lutter contre les phosphates. (l'eau de chaux précipite les phosphates dissous dans l'eau et transforme ceux-ci en matière insoluble sous forme solide non assimilables)
Il est à noter que le phosphore (la transformation de
matières organiques dispense du phosphore sous forme de
phosphates) est une substance importante pour la pousse des
algues. (inférieurs et supérieurs)
Le Silicium
L'apparition dans nos aquariums d'algues brunes,
de cyanobacteries
ou de diatomées est souvent due à un taux élevé de silicium (mis à part un éclairage défectueux
ou inadéquate ou bien encore un encrassement de l'écumeur), vous pouvez lutter contre cela en utilisant
uniquement de l'eau osmosée lors de vos changements d'eau ou lors de vos rajouts
d'eau évaporée, car l'eau du robinet est souvent trop riche en acide silicique. Si ces algues disparaissent, c'est
parce qu'elles ont tout simplement épuisées tout le silicium disponible dans le
bac.(la valeur des silicates ne doit pas dépasser 0.2 mg/l) Ne pensez donc pas
remédier au problème en effectuant un changement partiel de votre eau car dans
ce cas ce sont les algues elles même que vous allez nourrir !
Attention aussi à votre substrat, si il est de mauvaise qualité, il se peut qu'
il ait une très forte concentration de silicium. Il existe maintenant des tests
pour tester le taux de silicium dans votre bac.

Le Calcium

Le calcium est
indispensable
à la construction du squelette corallien. Il est présent dans l'eau de mer sous
forme dissoute, et il est partiellement absorbé par les coraux (puis synthétisé)
mais aussi par les mollusques (pour leur coquille, leur carapace). La synthèse de ce carbonate
de calcium à besoin de 2 éléments : le dioxyde de carbone et le calcium sous
forme ionique. La concentration en calcium diminue progressivement dans le bac
car les organismes l'absorbent et le consomment, il faut donc procéder à un
apport constant en calcium. Il y a plusieurs procédés pour cela :
-
l'eau de chaux (hydroxyde de calcium)
-
le réacteur à calcium (automatisation de l'apport d'eau de chaux)
-
la supplémentation par apport de calcium liquide
-
les changements d'eau
réguliers à hauteur de 10 % du volume du bac, voir 20 %
Certains
sont aussi tentés de pousser le taux de calcium au delà de 600 mg/l. Encore une
fois, mieux vaut rester dans des valeurs approchant le taux naturel, les
résultats ne sont jamais à la hauteur de nos espérances. Un certain chinois dans
les années 60 avait déjà tout compris... Le taux naturel du calcium dans l'eau
de mer est d'environ 450 mg/l (taux qui me semble un bon compromis) ne dépassez pas 550 mg/l. Le Magnésium
 Preis
Magnésium. Preis
Magnésium.
C'est un composant extrêmement important en eau de mer, d'ailleurs, le
troisième en quantité après le chlorure et le sodium (qui en s'associant forment
le chlorure de sodium)car la teneur du Mg en eau de mer naturelle est d'environ 1300 mg/l. (quand le calcium reste lui à 400 mg/l !) Le calcium s'évapore rapidement si la teneur en magnésium baisse, l'un ne va pas sans l'autre... Le magnésium est aussi un élément important dans la croissance des algues corallines. Une récente découverte nous démontre que le magnésium aide à lutter contre les phosphates (la liaison du phosphate n'est possible qu'avec un taux suffisant de magnésium dans le bac.) La supplémentation dans un bac récifal ne saurait se passer sans magnésium. Pour ma
part il m'arrive de pratiquer de temps en temps et en quantité raisonnable un
apport de magnésium dans mes bacs avec une solution de la marque Preis.
 Magnésium
Pro de Grotech. Magnésium
Pro de Grotech.
Le
problème principal est que l'adjonction d'hydroxyde de calcium régulière peut provoquer
une forte carence en magnésium, car il peut y avoir une précipitation des sels de
magnésium sous une forme insoluble. Il faut donc dissocier et espacer ces deux
apports dans le temps. La norme est de 1,30 g/l. Dans les bacs qui
présentent une carence en magnésium, le calcium s'épuise plus rapidement que le
carbonate de calcium, il est donc important de ne pas négliger cet apport dans
les aquariums contenant de nombreux coraux durs et/ou mous...
L' Eau Osmosée
On en parle
beaucoup, et ce n'est pas pour rien... L'eau osmosée est la résultante d'une
technique appelé : l'osmose inverse. L'eau de nos villes et même de nombreuses
campagnes est vraiment polluée, elle est bien sur consommable par les humains
(quoique...!), mais dans le cas qui nous intéresse, mieux vaut avoir une qualité
d'eau irréprochable afin d'éviter les futurs problèmes. C'est la raison pour
laquelle nous faisons appel à cette technique maintenant parfaitement maîtrisée
depuis plusieurs années et qui nécessite un investissement assez léger.

L'eau qui circule dans nos canalisations est soumise à une certaine pression, c'est donc cette pression que nous allons utilisée pour introduire l' eau
de conduite dans l'appareil. Cette eau passera d'abord dans un préfiltre afin de retirer
entre autre, le chlore, puis elle passe ensuite dans une membrane (sensible au chlore) qui retire tout les sels minéraux, toutes les impuretés,
les oligo-éléments, les dioxines, les pesticides, les herbicides, les métaux
lourds, les bactéries, les virus, les nitrates (normalement) et tout le reste. Conclusion, vous avez de l'eau pure à 98 % qui sort
du système. Idéal pour l'aquariophilie récifale ou marine. Le seul reproche que l'on peut faire à ce système est la consommation
excessive d'eau, en effet, il faut 4 litres d'eau de rejet pour 1 litre d'eau osmosée.
Il existe de nos jours des osmoseurs qui consomment un peu moins d'eau.(comptez
120 euros pour un bon modèle, environ 49 euros pour un modèle bas de gamme sur
le net)
Le gaz carbonique
Une mode se profile à l'horizon, qui est de rajouter du gaz carbonique dans les bacs
marins ! On croit rêver ?! (pratique souvent utilisée en eau douce et dans
les bacs abondamment plantés) Sous prétexte que certains anthozoaires absorbent du CO2 en grande quantité, on surdose l'eau en faisant des injections contrôlées, le résultat est sans appel : une forte poussée d'algues filamenteuses...D'autre part, faut-il rappeler que l'air que nous respirons contient déjà du gaz carbonique ? L'échange se fait donc en surface de nos bacs, et ce, en quantité suffisante.
D'ailleurs, j'en profite pour vous rappeler qu'il est absolument nécessaire dans
un bac marin de bien brasser la surface de l'eau, même énergiquement. Ce qui est
applicable en eau douce ne l'est pas forcement en eau de mer. L'injection du CO2
dans un bac marin peut éventuellement se faire avec un réacteur à calcaire à
injection (et avec l'aide d'un Ph mètre électronique pour vérifier le taux de Ph)afin
de dissoudre des granulés calcaires qui sont sensés maintenir un taux de calcium
élevé et maintenir un Kh à 8.
 Un kit JBL. Un kit JBL. Ici
un kit Tunze avec son RAC (réacteur à calcaire) Ici
un kit Tunze avec son RAC (réacteur à calcaire)
L'eau de mer naturelle
 Ah
l'eau de mer naturelle...! Ah
l'eau de mer naturelle...!
Si vous tenez absolument a mettre de l'eau de mer naturelle, il est évident
pour tout le monde qu'il faille la puiser assez loin du rivage, surtout en
France malheureusement. La pollution sur nos côtes est encore trop importante. Allez au moins à 300 mètres des côtes, et prenez l'eau en profondeur et non en surface. Il faut la brasser
énergiquement et l'oxygéner avant de la mettre dans votre bac.(ne pas oubliez
d'équilibrer la densité avec de l'eau osmosée si elle est trop importante, plus
de 1026)
Attention, plus la température augmente, plus la densité baisse. Si possible,
l'eau doit être stockée à l'abri de toute source lumineuse afin d'éviter une prolifération de bactéries. Vérifiez aussi la température. Il est inutile de la filtrer (comme j'ai pu souvent le lire) car vous perdriez tout le bénéfice du micro plancton contenu dans l'eau. Ensuite, versez-la au goutte à goutte
à température équivalente dans votre bac en ayant pris soin de contrôler le taux de nitrates, de nitrites et de phosphates.(tout doit être
normalement à 0 mg/l) Tout ça c'est bien joli, mais moi j'habite loin de la mer
et je n'ai pas de bateau, alors ?
Certains
commerces vendent de l'eau de mer naturelle, mais je ne vous le conseille pas,
il vaut mieux l'avoir "fraîche". Elle est en général stockée trop longtemps chez
le détaillant et vous en perdriez tout son bénéfice. Mais vous pouvez essayer
aussi les aquariums publics (près des côtes), parfois ça marche...
Pour stocker l'eau chez vous, utilisez des bidons en plastique de qualité alimentaire ou bien des cuves en verre collé, il faut absolument la brasser énergiquement en surface et en profondeur, la chauffer à 25 degrés et ne surtout pas dépasser une semaine de stockage. Vous verrez que l'eau de mer naturelle a un effet bénéfique sur les
tous animaux de l'aquarium. Faites-le l'hiver car la pollution est moins importante qu'en été.( je ne dis pas ça pour les crèmes solaires !)
Il faut reconnaître que cette technique ne concerne que quelques amateurs privilégiés...Pour le reste des récifalistes, le sel synthétique fera
parfaitement l'affaire.
La Composition
chimique de l'eau de mer
Il est évident que l'eau de mer synthétique n'a pas les mêmes qualités que l'eau de mer naturelle. Cependant , les industriels ont fait d'énormes progrès et on peut
depuis de longues années maintenir dans de parfaites conditions des animaux marins avec de tel sels. La qualité principale de l'eau de mer naturelle tient au fait qu'elle est chimiquement beaucoup plus complète
et "vivante". A cela on peut répondre que l'eau synthétique possède l'avantage de ne contenir aucun organisme pathogène.
Le sel dissous le plus représenté dans l'eau de mer est le chlorure de sodium, d'ailleurs, on défini la salinité en fonction de sa concentration. La norme de définition est exprimée en grammes par litre, la moyenne étant de 35 g/l.
Sachez que l'on retrouve dans l'eau de mer (d'après des analyses extrêmement poussées) quasiment tous les éléments présents sur notre planète. L'eau de mer constitue donc un mélange d'une grande complexité. Voici donc quelques constituants, à nous de définir à quoi ils peuvent servir en biologie
marine :
Principaux composants :
Chlore / Sodium / Magnésium / Calcium / Strontium /
Potassium / Soufre / Carbone / Brome / Bore
Autres composants :
Argent /
Aluminium / Antimoine / Argon / Arsenic /
Barium /
Béryllium / Bismuth / Cadmium / Carbonates / Cérium / Cobalt / Cuivre / Chrome / Césium / Crypton / Erbium / Etain / Dysprosium / Europium / Fer / Fluor / Gadolinium / Gallium / Germanium / Hélium / Hafnium Holmium / Indium / Indium / Iode / Lanthane / Lithium
/ Lutetium / Manganèse /
Mercure / Molybdène / Néodyme / Niobium / Nickel / Or / Phosphore / Platine / Plomb / Praséodyme / Protactinium / Radium / Rubidium / Radon / Radium / Samarium /
Scandium / Sélénium / Silicium /
Tantale / Terbium / Thallium / Thulium / Titane / Thorium / Tungstène / Uranium / Vanadium / Ytterbium / Yttrium / Zinc / Zirconium
Gaz :
Hydrogène / Oxygène / Anhydride carbonique / Argon / Krypton / Néon / Xénon
Éléments en quantité infinitésimales :
Actinium / Astate / Iridium / Francium / Osmium / Platine / Palladium / Rhodium / Ruthénium / Technétium
Ceci étant dit, on a quand même une petite idée de la fonction de certains éléments, d'après S.Fournier et N.Leclercq (deux très bon spécialistes !):
le cobalt à un rôle structurel tout comme le calcium et le strontium, le brome un rôle immunitaire, le chlore à un rôle dans la photosynthèse ainsi que le fer, le potassium agit sur la régulation osmotique, le manganèse sur la structure des coraux et aussi sur la photosynthèse, l'iode sur le métabolisme (et je rajouterai sur la coloration
de certains coraux), le sodium sur une activation enzymatique ainsi que le soufre, le molybdène sur une réduction des nitrates et sur la fixation de l'azote atmosphérique et enfin le magnésium sur l'activation enzymatique, la pigmentation photosynthétique (et je rajouterai sur la fixation du calcium )

Oui moi aussi j'aimerai bien prélever un peu d'eau ici pour mon bac !
Suite
|